在A-Level化学U1中,有一个重要的知识点需要我们掌握,就是通过化学键和结构去区分化合物。
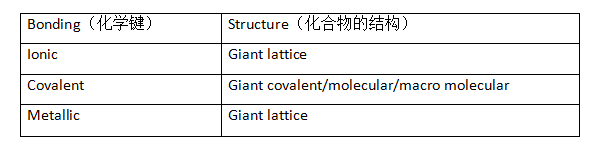
化学键包含了离子键(Ionic bonding),共价键(covalent bonding)和金属键(metallic bonding)。同时,因为键的种类不同会导致化合物的结构不同,因此它们表现出的物理性质也相对应的不同。
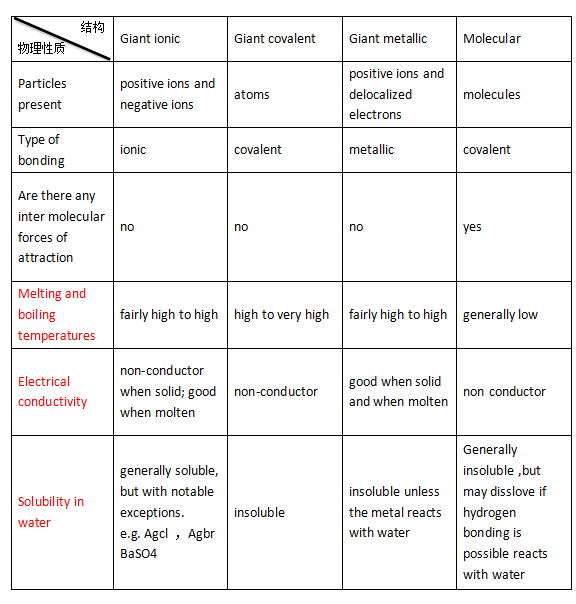
在上图表格中,包含了以下U1中三个重要考点
1、Melting and boiling temperatures(熔沸点)
要比较熔沸点高低,前提是分子结构、原子晶体、离子晶体、金属晶体间的离子键、金属键或共价键比较。化学键本身越牢固,破坏化学键需要的能量就越高,熔沸点也就越高。而分子结构下存在着分子内作用力(Inter molecular force),这个力的强度不高,所以它的熔沸点较低。
2、Electrical conductivity(导电性)
物质的导电性通常是由游离电子(Delocalized electrons)所影响的。如果电离子可以自由移动那么通常意义下它具有导电性。分子(Molecular)和 巨型共价结构(Giant covalent)由于只是共享电子,不产生电离子,所以他们是绝缘体(Non-conductor)。巨型离子结构(Giant ionic)本身存在电离子,但是固体情况下无法自由移动,融化以后电离子即可自由移动。所以它是固体不导电,融化后导电(Non-conductor when solid; good when molten)。巨型金属结构(Giant metallic)本身就具有游离电子(Delocalized electrons),所以金属导电性在固体和融化状态下都很好(good when solid and when molten)。
3、Solubility in water(可溶性)
物质的可溶性实质上取决于是否会被电解,这一点在U2中我们会具体进一步学习。这里只需要记住巨型共价结构(Giant covalent)完全不溶于水。巨型金属结构(Giant metallic)和分子结构(Molecular )不溶于水,除非和水发生反应才会溶于水。巨型离子结构(Giant ionic)溶于水,但是个别情况不溶于水,e.g. Agcl,AgbrBaSO4。
真题演练

这道题就是考查结构和化学键是如何影响导电性和高熔点的。
Electrical conductivity:
• the electrons can flow (under a potential difference)
High melting temperature:
• strong force of attraction between the (positive) ions and electrons
在上面的表格和题目中,我们可以发现考试会要求考生进行分辨和解释,此类型的题目只要加强记忆,熟练掌握知识点便可稳稳拿分。同时,在U2 Topic7中我们会再次接触到水解和可溶性的知识点,会对U1可溶性的知识进一步解释和完善。同学们理解了吗?